9月6日,国家药监局发布2022年度药品审评报告。报告显示,2022年,药审中心受理注册申请12368件,同比增长6.09%。受理需技术审评的注册申请9301件,同比增加0.71%。

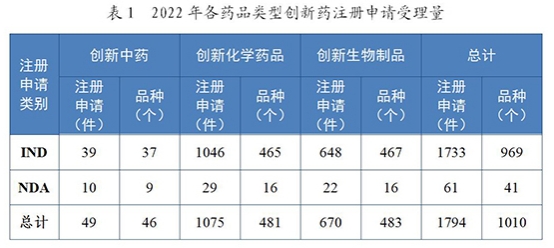
其中,2022年受理创新药注册申请1794件(1010个品种)。以药品类型统计,创新中药49件(46个品种)同比减少9.26%;创新化学药品1075件(481个品种),同比减少7.80%;创新生物制品670件(483个品种),同比增加0.60%。
国家药监局鼓励以临床价值为导向的药物创新,全年审评通过建议批准21个创新药。其中含3个首创新药(First-in-Class),分别为:
多格列艾汀片:由华领医药申报,单药使用或与盐酸二甲双肌联合使用以改善成人2型糖尿病患者的血糖控制,具有全新作用机制,为全球首个GKA类2型糖尿病治疗药物
奥木替韦单抗注射液:由华北制药申报,用于成人狂犬病毒暴露者的被动免疫,为我国自主研发的重组人源抗狂犬病毒单抗药物,能够满足狂犬病毒II级暴露者被动免疫的临床需求该品种的上市为狂犬病毒暴露者的被动免疫提供了新的选择。
佩索理单抗注射液:由勃林格殷格翰申报,用于治疗成人泛发性脓疱型银屑病(GPP)的急性发作。目前尚无 GPP 发作的有效治疗方法。本品种为境内外同步研发、同步上市,其能够快速持续清除脓疱和改善其他 GPP 皮肤症状。


此外,国家药监局表示,2022年多措并举鼓励儿童用药研发创新,儿童用药批准数量为66个,创历史新高。同时支持推动重要传承创新发展,10个中药新药(包含中药提取物)获批上市。
报告指出,2022年,共有228件药品注册申请,因申报资料无法证明其安全性、有效性或质量可控性,经技术审评后审评结论为不批准/建议不批准,同比增加24.59%,其中包括中药9件、化学药品179件、生物制品40件。
国家药监局表示,将进一步深化药品审评审批制度改革,鼓励药品研发创新扎实做好新冠疫苗药物应急审评工作,继续推进仿制药质量和疗效-致性评价,改革完善放射性药品审评机制,大力推进中药审评审批机制改革,夯实审评标准体系基础,不断提升审评体系和审评能力现代化水平。



