近日,武田制药官网发布公告,宣布公司经与美国食品药品监督管理局(FDA)商议,将在美国启动琥珀酸莫博赛替尼/mobocertinib(商品名:安卫力®/Exkivity®,以下简称“莫博赛替尼”)的主动退市。

在美退市主因系III期研究未达到主要研究终点
公告显示,之所以做出上述决定是由于III期EXCLAIM-2确证性研究未达到主要研究终点,不符合FDA和其他国家及地区监管机构授予莫博赛替尼加速批准/附条件批准上市的确证性研究数据要求。
EXCLAIM-2是一项III期、多中心、开放标签试验,旨在研究莫博赛替尼单药对比含铂化疗,用于一线治疗携带EGFR 20号外显子插入突变的局部晚期或转移性非小细胞肺癌患者的安全性和疗效。在EXCLAIM-2试验中未观察到新的安全性问题。试验的完整数据将在即将举行的医学会议上公布,或发表在同行评审的期刊上。
莫博赛替尼是否在中国退市存在不确定性
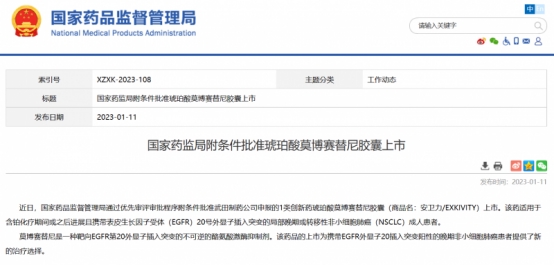
据悉,莫博赛替尼于2021年9月15日获FDA加速批准用于治疗治疗含铂化疗期间或之后进展且携带表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌成人患者。2023年1月11日,琥珀酸莫博赛替尼在中国获批上市。3月,其在中国开始销售,零售价为37588元/盒(40mg*112粒)。武田表示,正在与包括中国在内的其他莫博赛替尼已获批国家和地区的监管机构积极展开沟通,并将遵循当地法律法规的要求,制定后续计划。
武田称,将持续评估此事件的影响,并将在必要时更新2023财年(截至2024年3月31日)年度合并报表的业绩预测。今年8月,武田制药公布2023财年第一季度业绩。报告显示,第一财季实现营收10586亿日元,按实际汇率同比增长8.9%,按固定汇率同比增长3.7%,核心营业利润率达30.8%。
国内市场或受波及,同类适应症药物研发竞争激烈
据了解,除莫博赛替尼外,目前国内仅有迪哲医药的舒沃替尼于今年8月获批了这一适应症。
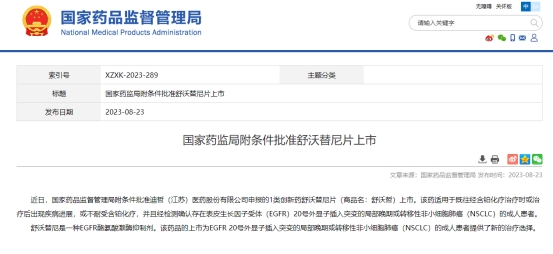
据迪哲医药2023半年报显示,舒沃替尼是目前首个或中美双“突破性疗法认定”的国创新药。2023ASCO大会上,迪哲医药首次披露了舒沃替尼单药一线治疗EGFR20号外显子插入突变型晚期非小细胞肺癌初步临床试验数据,在临床试验II期推荐(RP2D)剂量(300mg QD)下的最佳ORR(客观缓解率)达77.8%。
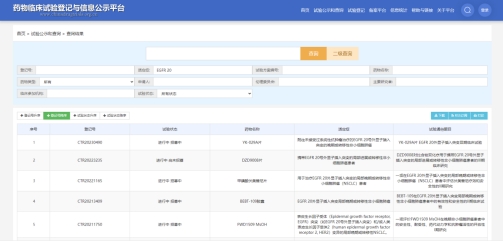
尽管如此,在同类适应证下的国内药物研发竞争依然激烈。据药物临床试验登记与信息公示平台查询显示,国内企业针对EGFR20号外显子插入突变的在研药物中,已有10余款进入临床阶段,其中已进入III期临床阶段的有浦合医药控股的海南越康生物医药有限公司所申报的YK-029A片以及上海艾力斯医药科技股份有限公司申报的甲磺酸伏美替尼片。



